Gócza Elen:
EMLŐSÁLLATOK KLÓNOZÁSA
(Forrás: Természet Világa, 128/8. szám, 1997. augusztus, 352-356. o.)
Ez év márciusában kelt szárnyra a hír: megszületett Dolly, az első
klónozott élőlény, amely kifejlett állat egyetlen testi sejtjéből származik.
Irásomban arra vállalkoztam, hogy bemutassam azt a folyamatot, ami Dolly
születéséhez vezetett, összefoglaljam azokat a kísérleteket, amelyeket az
elmúlt néhány évtizedben a klónozás területén folytattak és megismertessem
az olvasóval ezen eredmények tudományos jelentőségét. Nem titkolt szándékom
továbbá, hogy cikkemmel eloszlassam azokat a félelmeket és tévhiteket,
amelyek a hír hallatán felvetődnek. Mielőtt azonban belevágnék a
részletekbe, röviden és tömören bemutatom azokat a főbb lépéseket, amelyek
lehetővé tették Dolly megszületését.
A tudósok először felnőtt nőstény birka emlőszövetének sejtjeiből
sejttenyészetet hoztak létre. Aztán a tenyészet sejtjeit nyugalmi állapotba
hozták, hogy majd ugyanebben az állapotban olyan petesejtbe juttassák,
amelyből előzőleg eltávolították a sejtmagot. A következő lépésben a
befogadó sejtmag nélküli petesejt citoplazmáját és a donor emlőssejtet
elektromos impulzussal egyesítették, amely ezzel aktiválódott, osztódni
kezdett és elindult az embrionális fejlődés folyamata. Az így létrehozott
embriót végül álvemhes nőstény petevezetőjébe ültették. Az eredmény: néhány
hónap múlva megszületett Dolly, a Föld első klónozott emlősállata.
A klón genetikailag egységes sejtek populációja, amely egyetlen sejt
osztódásából keletkezik. Klónozáskor tehát az adott egyed egyetlen sejtjéből
kiindulva hoznak létre (genetikailag egységes) utódokat. A kiinduló sejt
lehet egyetlen baktérium-, gomba-, moszat- vagy szövettenyészetből származó
sejt, de lehet a magasabb rendű növények vegetatív szaporító szervének
sejtje is.
A növények testi sejtjéből kiindulva már számos növényfaj esetében
sikerült reprodukálni a teljes növényt, az egysejtű és gerinctelen állatok
körében viszont eleve elterjedt ez az ivartalan szaporodási mód.
Kétéltűekkel is végeztek klónozásos kísérleteket, melyek során [1] a tudósok
arra keresték a választ, hogy a különböző differenciáltsági állapotban levő
sejtek magjai azonos fejlődési potenciállal rendelkeznek-e vagy sem, s
létrehozhatók-e életképes utódok úgy, hogy ehhez már egy bizonyos fejlődési
stádiumba lépő (determinálódott) sejt magját használják fel. A determináció
folyamatát úgy értelmezték, hogy az embrionális fejlődés során egyre több
gén, géncsoport működése kerül gátlás alá a differenciálódó sejtekben. Ezzel
egyre jobban beszűkül a sejtek előtt az a lehetőség, hogy belőlük még
"bármi" kifejlődhessen (csökken a potenciájuk), s így egyre inkább
specializáltabb formába kerülnek. Eközben, kivéve bizonyos immunsejteket, a
DNS-tartalom azonos marad a fejlődés során valamennyi sejtben. A
sejtmagokban jelen van az egész szervezet létrehozásához és működéséhez
szükséges információ, ennek jelentékeny része azonban (ami nem az adott
differenciált sejtre jellemző tulajdonságot kódol) gátlás alatt van. Azt
feltételezték, hogy a citoplazma képes újraaktiválni ezeket a gátolt
géneket.
Amikor a kétéltűek petesejtjének sejtmagját besugárzással tönkretették
(enukleálták), az barázdálódott ugyan, de ezt követően elpusztult. Ha
mesterségesen, tűszúrással aktivált, enukleált békapetesejtbe
hólyagcsíra-(blasztula) állapotban levő, a békaembrió animális sejtjének
pólusán elhelyezkedő sejtmagot ültették be, akkor az így kapott embriók egy
része normálisan fejlődött tovább és ép ebihalak alakultak ki belőlük. Ezek
a kísérletek azt bizonyítják, hogy a fejlődés korai fázisában a sejtmagban
semmiféle irreverzibilis folyamat nem zajlik le. Az idősebb embriókból vett
sejtmagok azonban már csak igen alacsony százalékban voltak képesek az
embrionális fejlődés irányítására, életképes utódokat nem kaptak. Ezek az
eredmények viszont azt igazolják, hogy az idegcsíra kialakulásának
(neuruláció) idejétől kezdődően sok sejt magstruktúrájában olyan
irreverzibilis változások játszódnak le, amelyeket a citoplazmában található
faktorok önmagukban nem képesek visszaállítani, reprogramozni.
Klónozás embriósejttel
A 90-es évek kezdetétől emlősállatok embrióinak felhasználásával nagyon
sok munkacsoport folytatott klónozásos kísérleteket. A kutatók a klónozáshoz
kezdetben egy igen egyszerű, könnyen kivitelezhető módszert alkalmaztak:
32-128 sejtes embriókat vágtak félbe, s így egypetéjű ikreket hoztak létre.
[2] Mikromanipulátor segítségével megoldották ugyan a szedercsíra-állapotban
levő embriók négyfelé osztását, de ennél több darabra vágott embrióból,
illetve fejlettebb állapotban levő embriódarabokból már nem sikerült
életképes utódokat létrehozni (1. ábra).
''1. ábra Az emlősembrió fejlődéseď0
''2. ábra
Klónozás em-
lősembriósej-
tek felhaszná-
lásávalď0
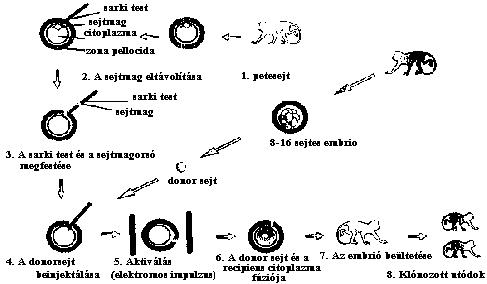
Az embriósokszorozás járhatóbb útjának látszott ezért a
sejtmagátültetéses módszer, amivel elméletileg nagyobb számban lehet ikreket
előállítani. E kísérletek során az úgynevezett befogadó (recipiens)
petesejtből kipipettázzák a sejtmagot és a sarki testet, majd citoplazmájába
beinjektálták egy másik sejt (donor) sejtmagját vagy a teljes sejtet. Azután
a két sejt citoplazmáját elektromos impulzus segítségével összeolvasztották
(fuzionáltatták). Az elektromos sokk egyúttal aktiválta is a petesejtet: az
embrió osztódni kezdett, s elindult a normális embrionális fejlődés (2.
ábra).
Az emlősállatok klónozására tett próbálkozások változatos eredményeket
hoztak. Nyolcsejtes állapotnál fejlettebb egérembriókból izolált sejteket
(blasztomereket), illetve az embriócsomóból származó sejteket vagy ES-
sejteket (lásd később) felhasználva nem kaptak élő utódokat. [3]
Szarvasmarha- és juhembrióból kiindulva több sikerrel jártak. Korai
szedercsíra-állapotú (morula) sejtekből is sikerült életképes utódokat
kapni, sőt a szarvasmarha- és a juhembrió embriócsomójából származó, rövid
ideig tenyésztett sejtek enukleált petesejtbe való beinjektálása is sikerrel
''3. ábra A sejtciklus fázisaiď0
járt. [4] A siker oka nem az volt, hogy a felhasznált sejtek totipotensek
voltak, azaz képesek voltak teljes szervezetet létrehozni, hanem az, hogy
találtak egy olyan módszert, amelynek segítségével a donor sejt sejtmagja és
a befogadó sejt citoplazmája között jobb lett az összhang. Ian Wilmut és
munkatársai a skóciai Roslin Intézetben bebizonyították, hogy a donor és a
recipiens sejtek állapotának összehangolása elengedhetetlenül szükséges. [5]
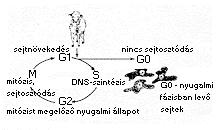
Az emlősöknél a legtöbb esetben a felhasznált sejtmag a sejtciklus S-
vagy G2-fázisában volt, ami nem felel meg a metafázis-II állapotban levő
petesejt citoplazmájának (3. ábra). Wilmut és munkatársai GO-fázisban levő
donor sejteket alkalmaztak, így jobb lett a szinkron a beültetett sejtmag és
a recipiens sejt citoplazmája között, ezáltal pedig jelentős mértékben
megnövekedett a reprogramozás hatékonysága.
A 90-es években hazánkban is elkezdődtek a klónozásos kísérletek. A
szarvasmarha- és juhklónozás területén szép eredményeink születtek.
Mosonmagyaróváron már 1984-ben hoztak létre iker bárányokat.
Embriószétválasztásos módszerrel sikerült megnégyszerezniük a
birkaembriókat. Az 1990-es években azonban áttértek a sejtmagátültetéses
kísérletekre. Négy klónozott juhot sikerült létrehozniuk.
A Gödöllői Mezőgazdasági Biotechnológiai Kutatóközpont
Állatbiotechnológiai Intézetében az 1990-es évek elejétől kezdődően szintén
zajlottak sejtmagátültetéses kísérletek in vitro módszerrel létrehozott
szarvasmarha-embriók sejtjeinek felhasználásával. Szedercsíra állapotú
(morula), klónozott embriókat sikerült létrehozniuk.
A sejtmagátültetéses kísérletek megteremtik az elvi lehetőségét a
nagyszámú, genetikailag azonos állatpopulációk létrehozásának. Az
állatbiotechnológia területén azonban nagyobb jelentőséggel bírna, ha
genetikailag módosított sejttenyészetekből kiindulva sikerülne életképes
utódokat létrehozni. Wilmut kutatócsoportjának 1996 elejére ezt is sikerült
megvalósítania, melyhez embrionális eredetű ős-sejtvonalból (az ES-
sejtvonalból) származó donor sejteket használtak fel. [4]
Embrionális eredetű ős-sejtvonalak
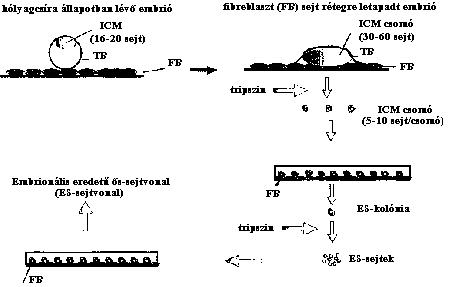
A hólyagcsíra állapotban levő emlősembrió (blasztociszta) kétféle
sejttípusból áll. A blasztociszta falát képező külső, úgynevezett
trofoblaszt réteg sejtjeiből (amelyek a magzat méhlepényének, illetve külső
magzatburkának képzésében vesznek részt) és a blasztociszta embriócsomójának
(inner cell mass, ICM) sejtjeiből. Ebből alakul ki maga az embrió, illetve a
belső magzatburok. A pluripotens embrionális eredetű ős-sejtvonalak a
''4. ábra
Embrionális erede-
tű ős-sejtvonalak
alapítása;
ICM - embriócsomó
(inner cell mass);
FB - fibroplaszt
sejtek;
TB - trofoblaszt
sejtekď0
blasztociszta embriócsomójából származtathatók (4. ábra).
Ha a blasztocisztát embrionális eredetű fibroblaszt rétegre helyezzük, a
blasztociszta letapad a fibroblaszt rétegre, a külső trofoblaszt réteg
sejtjei pedig óriás, sokmagvú sejtekké alakulva ránőnek arra, míg az ICM-
sejtjei szorosan együtt maradnak, s az ún. ICM-csomót hozzák létre. Ha a
blasztocisztát hagynánk tovább fejlődni, az ICM-csomó sejtjei
differenciálódni kezdenének. Ha azonban az ICM-csomót izoláljuk a
tenyészetből, s ezt tripszin-cseppben kisebb aggregátumokká
disszociáltatjuk, és ezeket az aggregátumokat friss fibroblaszt rétegre
helyezzük, ezek a kis csomók letapadnak, s különbözó morfológiájú kolóniákat
hoznak létre. Olyan kolóniák is létrejönnek, amelyek továbbra sem
differenciálódó, az ICM sejtjeihez hasonló sejtekből állnak. Ezeket a
kolóniákat ismét izolálni lehet a tenyészetből. A kolóniákat aztán tripszin-
cseppben sejtjeire disszociáltatjuk, s ezt a sejtszuszpenziót helyezzük
friss fibroblaszt sejtrétegre, azaz átpasszáljuk. Ha a keletkező újabb
kolóniák mind egyformák lesznek, s a további passzálások során sem változik
meg a morfológiájuk (kerekded, szorosan kapcsolódó, nagy sejtmagvú, apró
sejtekből épülnek fel), akkor mondhatjuk azt, hogy rendelkezésünkre áll egy
pluripotens embrionális eredetű ős-sejtvonal. Az ES-sejtvonalak optimális
tenyésztési körülmények mellett állandóan osztódó, nem differenciálódó
sejtekből épülnek fel. Az ES-sejteket le lehet fagyasztani, s így a
folyékony nitrogénben gyakorlatilag korlátlan ideig megőrizhetők. Ha a
tenyésztési feltételek megváltoznak, az ES-sejtek a legkülönbözőbb típusú
sejtekké képesek differenciálódni. Ha az ES-sejteket hólyagcsíra állapotban
levő gazdaembrióba injektáljuk vagy két nyolcsejtes gazdaembrióval
aggregáltatjuk, kiméra utódokat kaphatunk. A kimérák minden szövetében,
szervében megtalálhatók lesznek az ES-sejtvonalból származó sejtek, így az
ivarsejtek között is.
Az 1990-es évek során hörcsög-, sertés-, szarvasmarha-, amerikainyérc-,
nyúl-, majom-, patkányembrióból kiindulva is alapítottak ES-jellegű
sejtvonalakat. Ezek a sejtvonalak folyamatosan passzálhatók, tenyészetben
fenntarthatók, megtartják differenciálatlan fenotípusukat és az ES-
sejtvonalak sejtjeire jellemző morfológiát mutatnak.
Klónozás tetraploid gazdaembrió felhasználásával
Ma két olyan módszer ismert, amely segítségével sejtvonal eredetű
utódokat lehet kapni ES-sejtekből kiindulva. Az első esetben egér-ES-
sejtvonal sejtjeit tetraploid gazdaembrióval aggregáltatva, a másikban pedig
birkaembrióból származó ES-sejtet enukleált petesejtbe injektálva kaptak
teljesen sejtvonal eredetű állatokat.
Nagy előretörést jelentett az ES-sejtvonalakból kiinduló klónozásos
kísérletek területén az, amikor Nagy András kutatócsoportjának sikerült
sejtvonal eredetű, életképes egereket létrehoznia. Még 1989-ben, az ELTE
Gödi Embriológiai Laboratóriumában elindultak ezek a klónozásos kísérletek.
Kétsejtes állapotban levő egérembrió két sejtjét fuzionáltatva
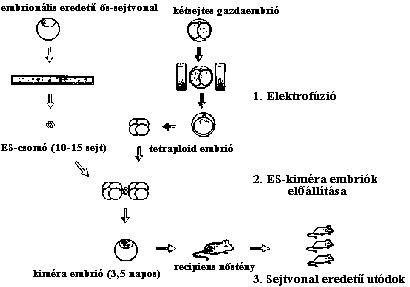
(elektrofúzióval) tetraploid egérembriókat hoztak létre. Ezeket a tetraploid
embriókat használták fel gazdaembrióként. Két-két tetraploid gazdaembriót
aggregáltattak egy-egy 15 ES-sejtet tartalmazó ES-csomóval. A két tetraploid
gazdaembrió és az ES-sejtcsomó egyetlen közös aggregátummá állt össze, majd
a normális embrionális fejlődés menetének megfelelően a morula állapotú
''5. ábra
Klónozás tetrapolid
gazdaembrióvalď0
embrióból hólyagcsíra állapotú embrióvá differenciálódott. Az így kapott ES-
kiméra embriókat álvemhes nőstény méhébe ültették. A világra jött állat
sejtvonal eredetű volt, de születése után néhány órával elpusztult (5.
ábra).
Ezt követően számos új egér-ES-sejtvonalat alapítottak és próbáltak ki
klónozásos kísérletekben, míg végül az R1 elnevezésű sejtvonalat
felhasználva sikerült (ES-sejtvonal eredetű) életképes állatokat
előállítaniuk. Ma szinte az egész világon ismert ez az R1-sejtvonal, s
nagyon sok laboratóriumban ebből a sejtvonalból kiindulva állítanak elő
transzgénikus ES-sejtvonalakat.
Klónozás birkaemlősejtek felhasználásával
Campbell, Wilmut és munkatársai 1996-ban tudósítottak arról, hogy birka
ES-sejtvonal sejtjeit enukleált birkapetesejtbe injektálva életképes
sejtvonal eredetű utódokat kaptak, amelyhez a sejtmag-átültetéses
kísérletekhez alkalmazott módszert használták fel. A recipiens petesejtből
eltávolították a metafázis-II állapotban levő kromoszómákat, a poláros
testet és a poláros test közvetlen közelében levő citoplazma egy kis
mennyiségét is. Ezt követően birka-ES-sejtet injektáltak az enukleált
petesejtbe, majd elektromos impulzussal segítették elő a recipiens petesejt
és a donor ES-sejt fúzióját. Ez az elektromos impulzus egyben aktiválta is a
petesejtet; s ezzel kezdetét vette a normális embrionális fejlődés. Az így
kapott egysejtes embriókat, ill. az in vitro blasztocisztává fejlődött
embriókat anyaállatba ültették. Sejtvonal eredetű életképes utódokat kaptak.
1997 februárjában ugyanez a kutatócsoport egy újabb publikációt jelentetett
meg, amely az egész világot bejárta. A szenzációt ez esetben az jelentette,
hogy egy felnőtt állat testi sejtjéből, pontosabban egy hatéves birka
emlőszövetéből kivett sejtből hozták létre a nőstény állat genetikai
másolatát (6. ábra).
Wilmut és munkatársai háromféle kísérletet végeztek, az elsőben ES-
sejteket, a másodikban a birkaembrió fibroblaszt sejtjeit; a harmadikban
pedig felnőtt állatból izoláltak emlőssejteket. Aztán mindegyik sejtből egy-
egy sejttenyészetet hoztak létre. A sejteket felszaporították, majd a
''6. ábra
Klónozás birka-
emlősejtek fel-
használásával
sejttenyésztő médiumban levő FCS (fetal calf serum) szintjét O,5%-ra
csökkentették. Az alacsony szérumszint hatására a sejtek GO, azaz nyugalmi
fázisba kerültek. A sejttenyészetekből azután egy-egy ilyen nyugalmi
fázisban levő sejtet izoláltak. Ezeket a donor sejteket olyan petesejtbe
injektálták, amelyekből előzőleg eltávolították a sejtmagot és a sarki
testet. A donor sejt és a befogadó recipiens petesejt citoplazmája
elektromos impulzus hatására fúzionált, majd az embrió osztódni kezdett. Ezt
követően az embriót hormonálisan előkészített nőstény állat méhébe ültették.
Mindhárom sejttípus esetében sikerült életképes utódot kapniuk.
Az ES-sejtek, illetve az embrionális eredetű fibroblaszt sejtek
felhasználásához az utódállatok egy ismeretlen tulajdonságú és fenotípusú
embrió genotípusát hordozták. Az emlősejt-tenyészetből kiindulva kapott
utód, Dolly azonban egy ismert tulajdonságú anyaállat genetikai másolata
volt, az első olyan állat a világon, amely felnőtt állat testi sejtjéből
jött létre. Dolly azonban nem tekinthető az emlősejtet adó anyajuh
hasonmásának!
Az egypetéjű ikrekkel folytatott kísérletekbői is kiderült, hogy nincs
két tökéletesen egyforma iker, így az sem várható, hogy klónozással
tökéletesen egyforma utódokat lehessen létrehozni. A genetikailag azonos
ikerállatokat az embrionális fejlődés során, s a megszületést követően is
eltérő környezeti hatások érhetik. A sejtmagátültetések során pedig nemcsak
a donor sejt nukleuszában levő genetikai információ kerül bele az utódba,
hanem a recipiens petesejt citoplazmájában maradó mitokondriumokban levő
mitokondriális DNS is. Az emlősejtek genetikai anyaga a sejtek élete során
sérülhetett, különböző mutációk jöhettek létre, így az emlősejt maga sem
tekinthető már az anyai genom tökéletes másolatának.
Ezért vetődhet fel a kérdés: hány éves is Dolly, ha a recipiens petesejt
citoplazmája egy idősebb sejttel fuzionált? Vajon melyik alkotórész hatása
érvényesül és hány évig fog élni Dolly? Ezekre a kérdésekre Dolly
megfigyelése adhatja csak meg a választ, ami felbecsülhetetlen információkat
nyújthat még az öregedési folyamat kutatóinak.
Ez a leírt módszer még korántsem tekinthető tökéletesnek. Összesen 277
petesejtet használtak fel, míg egyetlen életképes utódot sikerült
létrehozniuk. Az emlősejt-tenyészetben háromféle sejttípust figyeltek meg a
tudósok: emlőhámsejteket, kötőszöveti sejteket, és előfordultak totipotens
őssejtek is. Wilmut és munkatársai nem tudták pontosan megállapítani, hogy
melyik sejttípusból is származik Dolly. Elképzelhető, hogy kivételes
szerencse folytán egy őssejt jellegű sejtet találtak, s más szövetek, sejtek
esetében az általuk ismertetett módszer nem használható.
A birka- és szarvasmarha-embriók korai embrionális fejlődése is eltérő
más emlősök embrionális fejlödésétől, így az egér és ember embrionális
fejlődésétől is. Szarvasmarha- és juhembriók esetében 16 sejtes állapot után
történik csak először átírás (transzkripció) az embrió saját DNS-éről, az
ezt megelőző időszakban a citoplazmájában felhalmozott anyagokat használja
fel. Más fajok embrióiban ennél jóval hamarabb, már kétsejtes (egér),
illetve korai nyolcsejtes állapotban (nyúl, majom, ember) megtörténik a
transzkripció. [7]
Az előbbiekben említett gondolatok is alátámasztják azokat a
megállapításokat, amelyek szerint az ember testi sejtjeiből kiinduló
klónozás, a "szép új világ" utópiájának megvalósulása nem várható a
közeljövőben.
Számos országban már napjainkban is tiltják az ember klónozását célzó
kísérleteket, s több világszervezet állásfoglalása szerint sem fogadható el
az ember klónozása. Maga Ian Wilmut is azt mondta: "Embert klónozni
embertelen lenne." Az emberiség nagy erénye éppen annak sokféleségében
rejlik.
A juhok klónozása figyelemre méltó tudományos eredmény, amelynek komoly
haszna lehet az orvostudományban és a mezőgazdaságban is. Az ES-
sejttenyészetekből származó sejtek alkalmazása pedig új lehetőségeket
biztosít szelektált, uniformizált, genetikailag azonos állatok
előállítására. A klónozott állatok létrehozása hatalmas előrelépést
jelenthet mind az alapkutatás, mind a biotechnológiai és agrárkutatások
területén. A transzgénikus ES-sejtvonalak előzetes szelektálásának
lehetősége olyan új módszert biztosít a tudomány számára, amely
felhasználásával egy teljes populáció gyors és célzott genetikai módosítása
válik lehetővé. A magátültetéses kísérletek tökéletesítésével új lehetőség
nyílt az embriológusok és a molekuláris genetikusok számára. Például az,
hogy megismerjék az embrionális fejlődés, a sejtdifferenciálódás, illetve a
sejtek öregedése során zajló változások molekuláris mechanizmusának főbb
lépéseit (mint például genom-imprinting, illetve a kromoszómarövidülés
folyamata), amelyek a szomatikus sejtekben zajlanak le.
Jegyzetek
[1] Gurdon, J. B. (1975) J. Embryol. Exp. Morph. 34, 93-112.
[2] Willadsen, S. M. (1986) Nature 320, 63-65.
[3] Tsunoda, Y. (1993) Reprod. Fert. 98, 537-540.
[4] Campbell (1996) Nature 380, 64-66.
[5] Wilmut, I. (1997) Nature 385, 810-813.
[6] Nagy, A., (1990) Development 110, 815-821.
[7] Crosby, I. M. (1988) J. Reprod. Fert. 82, 755-769.
Kislexikon
animális sejtek: ---- a petesejt szikben szegény citoplazmájú pólusánál
kialakuló sejtek
blasztociszta: ------ hólyagcsira állapotú embrió
blasztomerák: ------- barázdálódási sejtek
blasztula: ---------- hólyagcsíra állapotú embrió
determináció: ------- a fejlődés során az a folyamat, amelyben eldől, hogy
a sejtek milyen irányba differenciálódhatnak
elektromos fúzió: --- elektromos impulzus hatására összeolvad két baráz-
dálódási sejt
ES-sejtvonal: ------- embrionális eredetű őssejtvonal
fenotípus: ---------- az egyed külső és belső tulajdonságainak az összessége
gasztruláció: ------- a barázdálódáskor létrejött sejtek a gasztruláció
során végleges helyükre kerülnek, kialakulnak a
különböző csíralemezek, amelyekből kiindulva
megindulhat a szervképződés folyamata
genom-imprinting: --- bizonyos gének esetében a DNS által kódolt genetikai
információ módosulhat, egy a DNS-szálra másodlagosan
rátevődő nem genetikai információtól (például a DNS
metilálódása által)
genotípus: ---------- a génekben tárolt genetikai információk összessége
in vitro tenyészetek: az eredeti környezetükből kiszakítva tanulmányoznak
biológiai folyamatokat, szövet-, szem-, sejttenyésze-
teket felhasználva
inner cell mass: ---- a hólyagcsíra állapotú embrió embriócsomója
irreverzibilis: ----- visszafordíthatatlan
kiméra: ------------- különböző eredetű sejtpopulációból felépülő egyed
klón: --------------- egyetlen egyedből ivartalan úton származó genetikailag
egységes utódok összessége
mikromanipulátor: --- olyan készülék, amely alkalmas mikronos méretű pipet-
ták, kések mozgatására
mitokondrium: ------- az oxidatív foszforiláció szolgálatában álló energia-
termelő sejtszervecske
morula: ------------- szedercsíra állapotú embrió
neuruláció: --------- a nerula (idegcsíra) kialakulásának folyamata
passzálás: ---------- sejttenyészetek feltripszinezése után kapott sejt-
szuszpenzió friss, tápláló sejtrétegre helyezése
pluripotens sejtek: - az embrionális fejlődés során szükséges majdnem minden
információt tartalmazó sejtek
poláros testek: ----- sarki testek, a petesejt érése során kizáródó sejtek
reprogramozás: ------ a már egyszer elfedett információ ismét felhasználha-
tóvá válása
tetraploid embrió: -- a kétsejtes embrió két diploid sejtjének összeolvadá-
sát követően létrejövő négyszeres kromoszóma számú
sejtekből álló embrió
totipotens sejtek: -- az embrionális fejlődés során szükséges minden infor-
mációt tartalmazó sejtek
transzkripció: ------ DNS-ről történő RNS-átírás folyamata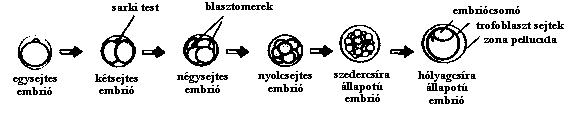 ''1. ábra Az emlősembrió fejlődéseď0
''1. ábra Az emlősembrió fejlődéseď0
 ''2. ábra
Klónozás em-
lősembriósej-
tek felhaszná-
lásávalď0
Az embriósokszorozás járhatóbb útjának látszott ezért a
sejtmagátültetéses módszer, amivel elméletileg nagyobb számban lehet ikreket
előállítani. E kísérletek során az úgynevezett befogadó (recipiens)
petesejtből kipipettázzák a sejtmagot és a sarki testet, majd citoplazmájába
beinjektálták egy másik sejt (donor) sejtmagját vagy a teljes sejtet. Azután
a két sejt citoplazmáját elektromos impulzus segítségével összeolvasztották
(fuzionáltatták). Az elektromos sokk egyúttal aktiválta is a petesejtet: az
embrió osztódni kezdett, s elindult a normális embrionális fejlődés (2.
ábra).
Az emlősállatok klónozására tett próbálkozások változatos eredményeket
hoztak. Nyolcsejtes állapotnál fejlettebb egérembriókból izolált sejteket
(blasztomereket), illetve az embriócsomóból származó sejteket vagy ES-
sejteket (lásd később) felhasználva nem kaptak élő utódokat. [3]
Szarvasmarha- és juhembrióból kiindulva több sikerrel jártak. Korai
szedercsíra-állapotú (morula) sejtekből is sikerült életképes utódokat
kapni, sőt a szarvasmarha- és a juhembrió embriócsomójából származó, rövid
ideig tenyésztett sejtek enukleált petesejtbe való beinjektálása is sikerrel
''2. ábra
Klónozás em-
lősembriósej-
tek felhaszná-
lásávalď0
Az embriósokszorozás járhatóbb útjának látszott ezért a
sejtmagátültetéses módszer, amivel elméletileg nagyobb számban lehet ikreket
előállítani. E kísérletek során az úgynevezett befogadó (recipiens)
petesejtből kipipettázzák a sejtmagot és a sarki testet, majd citoplazmájába
beinjektálták egy másik sejt (donor) sejtmagját vagy a teljes sejtet. Azután
a két sejt citoplazmáját elektromos impulzus segítségével összeolvasztották
(fuzionáltatták). Az elektromos sokk egyúttal aktiválta is a petesejtet: az
embrió osztódni kezdett, s elindult a normális embrionális fejlődés (2.
ábra).
Az emlősállatok klónozására tett próbálkozások változatos eredményeket
hoztak. Nyolcsejtes állapotnál fejlettebb egérembriókból izolált sejteket
(blasztomereket), illetve az embriócsomóból származó sejteket vagy ES-
sejteket (lásd később) felhasználva nem kaptak élő utódokat. [3]
Szarvasmarha- és juhembrióból kiindulva több sikerrel jártak. Korai
szedercsíra-állapotú (morula) sejtekből is sikerült életképes utódokat
kapni, sőt a szarvasmarha- és a juhembrió embriócsomójából származó, rövid
ideig tenyésztett sejtek enukleált petesejtbe való beinjektálása is sikerrel
 ''3. ábra A sejtciklus fázisaiď0
járt. [4] A siker oka nem az volt, hogy a felhasznált sejtek totipotensek
voltak, azaz képesek voltak teljes szervezetet létrehozni, hanem az, hogy
találtak egy olyan módszert, amelynek segítségével a donor sejt sejtmagja és
a befogadó sejt citoplazmája között jobb lett az összhang. Ian Wilmut és
munkatársai a skóciai Roslin Intézetben bebizonyították, hogy a donor és a
recipiens sejtek állapotának összehangolása elengedhetetlenül szükséges. [5]
Az emlősöknél a legtöbb esetben a felhasznált sejtmag a sejtciklus S-
vagy G2-fázisában volt, ami nem felel meg a metafázis-II állapotban levő
petesejt citoplazmájának (3. ábra). Wilmut és munkatársai GO-fázisban levő
donor sejteket alkalmaztak, így jobb lett a szinkron a beültetett sejtmag és
a recipiens sejt citoplazmája között, ezáltal pedig jelentős mértékben
megnövekedett a reprogramozás hatékonysága.
A 90-es években hazánkban is elkezdődtek a klónozásos kísérletek. A
szarvasmarha- és juhklónozás területén szép eredményeink születtek.
Mosonmagyaróváron már 1984-ben hoztak létre iker bárányokat.
Embriószétválasztásos módszerrel sikerült megnégyszerezniük a
birkaembriókat. Az 1990-es években azonban áttértek a sejtmagátültetéses
kísérletekre. Négy klónozott juhot sikerült létrehozniuk.
A Gödöllői Mezőgazdasági Biotechnológiai Kutatóközpont
Állatbiotechnológiai Intézetében az 1990-es évek elejétől kezdődően szintén
zajlottak sejtmagátültetéses kísérletek in vitro módszerrel létrehozott
szarvasmarha-embriók sejtjeinek felhasználásával. Szedercsíra állapotú
(morula), klónozott embriókat sikerült létrehozniuk.
A sejtmagátültetéses kísérletek megteremtik az elvi lehetőségét a
nagyszámú, genetikailag azonos állatpopulációk létrehozásának. Az
állatbiotechnológia területén azonban nagyobb jelentőséggel bírna, ha
genetikailag módosított sejttenyészetekből kiindulva sikerülne életképes
utódokat létrehozni. Wilmut kutatócsoportjának 1996 elejére ezt is sikerült
megvalósítania, melyhez embrionális eredetű ős-sejtvonalból (az ES-
sejtvonalból) származó donor sejteket használtak fel. [4]
Embrionális eredetű ős-sejtvonalak
A hólyagcsíra állapotban levő emlősembrió (blasztociszta) kétféle
sejttípusból áll. A blasztociszta falát képező külső, úgynevezett
trofoblaszt réteg sejtjeiből (amelyek a magzat méhlepényének, illetve külső
magzatburkának képzésében vesznek részt) és a blasztociszta embriócsomójának
(inner cell mass, ICM) sejtjeiből. Ebből alakul ki maga az embrió, illetve a
belső magzatburok. A pluripotens embrionális eredetű ős-sejtvonalak a
''3. ábra A sejtciklus fázisaiď0
járt. [4] A siker oka nem az volt, hogy a felhasznált sejtek totipotensek
voltak, azaz képesek voltak teljes szervezetet létrehozni, hanem az, hogy
találtak egy olyan módszert, amelynek segítségével a donor sejt sejtmagja és
a befogadó sejt citoplazmája között jobb lett az összhang. Ian Wilmut és
munkatársai a skóciai Roslin Intézetben bebizonyították, hogy a donor és a
recipiens sejtek állapotának összehangolása elengedhetetlenül szükséges. [5]
Az emlősöknél a legtöbb esetben a felhasznált sejtmag a sejtciklus S-
vagy G2-fázisában volt, ami nem felel meg a metafázis-II állapotban levő
petesejt citoplazmájának (3. ábra). Wilmut és munkatársai GO-fázisban levő
donor sejteket alkalmaztak, így jobb lett a szinkron a beültetett sejtmag és
a recipiens sejt citoplazmája között, ezáltal pedig jelentős mértékben
megnövekedett a reprogramozás hatékonysága.
A 90-es években hazánkban is elkezdődtek a klónozásos kísérletek. A
szarvasmarha- és juhklónozás területén szép eredményeink születtek.
Mosonmagyaróváron már 1984-ben hoztak létre iker bárányokat.
Embriószétválasztásos módszerrel sikerült megnégyszerezniük a
birkaembriókat. Az 1990-es években azonban áttértek a sejtmagátültetéses
kísérletekre. Négy klónozott juhot sikerült létrehozniuk.
A Gödöllői Mezőgazdasági Biotechnológiai Kutatóközpont
Állatbiotechnológiai Intézetében az 1990-es évek elejétől kezdődően szintén
zajlottak sejtmagátültetéses kísérletek in vitro módszerrel létrehozott
szarvasmarha-embriók sejtjeinek felhasználásával. Szedercsíra állapotú
(morula), klónozott embriókat sikerült létrehozniuk.
A sejtmagátültetéses kísérletek megteremtik az elvi lehetőségét a
nagyszámú, genetikailag azonos állatpopulációk létrehozásának. Az
állatbiotechnológia területén azonban nagyobb jelentőséggel bírna, ha
genetikailag módosított sejttenyészetekből kiindulva sikerülne életképes
utódokat létrehozni. Wilmut kutatócsoportjának 1996 elejére ezt is sikerült
megvalósítania, melyhez embrionális eredetű ős-sejtvonalból (az ES-
sejtvonalból) származó donor sejteket használtak fel. [4]
Embrionális eredetű ős-sejtvonalak
A hólyagcsíra állapotban levő emlősembrió (blasztociszta) kétféle
sejttípusból áll. A blasztociszta falát képező külső, úgynevezett
trofoblaszt réteg sejtjeiből (amelyek a magzat méhlepényének, illetve külső
magzatburkának képzésében vesznek részt) és a blasztociszta embriócsomójának
(inner cell mass, ICM) sejtjeiből. Ebből alakul ki maga az embrió, illetve a
belső magzatburok. A pluripotens embrionális eredetű ős-sejtvonalak a
 ''4. ábra
Embrionális erede-
tű ős-sejtvonalak
alapítása;
ICM - embriócsomó
(inner cell mass);
FB - fibroplaszt
sejtek;
TB - trofoblaszt
sejtekď0
blasztociszta embriócsomójából származtathatók (4. ábra).
Ha a blasztocisztát embrionális eredetű fibroblaszt rétegre helyezzük, a
blasztociszta letapad a fibroblaszt rétegre, a külső trofoblaszt réteg
sejtjei pedig óriás, sokmagvú sejtekké alakulva ránőnek arra, míg az ICM-
sejtjei szorosan együtt maradnak, s az ún. ICM-csomót hozzák létre. Ha a
blasztocisztát hagynánk tovább fejlődni, az ICM-csomó sejtjei
differenciálódni kezdenének. Ha azonban az ICM-csomót izoláljuk a
tenyészetből, s ezt tripszin-cseppben kisebb aggregátumokká
disszociáltatjuk, és ezeket az aggregátumokat friss fibroblaszt rétegre
helyezzük, ezek a kis csomók letapadnak, s különbözó morfológiájú kolóniákat
hoznak létre. Olyan kolóniák is létrejönnek, amelyek továbbra sem
differenciálódó, az ICM sejtjeihez hasonló sejtekből állnak. Ezeket a
kolóniákat ismét izolálni lehet a tenyészetből. A kolóniákat aztán tripszin-
cseppben sejtjeire disszociáltatjuk, s ezt a sejtszuszpenziót helyezzük
friss fibroblaszt sejtrétegre, azaz átpasszáljuk. Ha a keletkező újabb
kolóniák mind egyformák lesznek, s a további passzálások során sem változik
meg a morfológiájuk (kerekded, szorosan kapcsolódó, nagy sejtmagvú, apró
sejtekből épülnek fel), akkor mondhatjuk azt, hogy rendelkezésünkre áll egy
pluripotens embrionális eredetű ős-sejtvonal. Az ES-sejtvonalak optimális
tenyésztési körülmények mellett állandóan osztódó, nem differenciálódó
sejtekből épülnek fel. Az ES-sejteket le lehet fagyasztani, s így a
folyékony nitrogénben gyakorlatilag korlátlan ideig megőrizhetők. Ha a
tenyésztési feltételek megváltoznak, az ES-sejtek a legkülönbözőbb típusú
sejtekké képesek differenciálódni. Ha az ES-sejteket hólyagcsíra állapotban
levő gazdaembrióba injektáljuk vagy két nyolcsejtes gazdaembrióval
aggregáltatjuk, kiméra utódokat kaphatunk. A kimérák minden szövetében,
szervében megtalálhatók lesznek az ES-sejtvonalból származó sejtek, így az
ivarsejtek között is.
Az 1990-es évek során hörcsög-, sertés-, szarvasmarha-, amerikainyérc-,
nyúl-, majom-, patkányembrióból kiindulva is alapítottak ES-jellegű
sejtvonalakat. Ezek a sejtvonalak folyamatosan passzálhatók, tenyészetben
fenntarthatók, megtartják differenciálatlan fenotípusukat és az ES-
sejtvonalak sejtjeire jellemző morfológiát mutatnak.
Klónozás tetraploid gazdaembrió felhasználásával
Ma két olyan módszer ismert, amely segítségével sejtvonal eredetű
utódokat lehet kapni ES-sejtekből kiindulva. Az első esetben egér-ES-
sejtvonal sejtjeit tetraploid gazdaembrióval aggregáltatva, a másikban pedig
birkaembrióból származó ES-sejtet enukleált petesejtbe injektálva kaptak
teljesen sejtvonal eredetű állatokat.
Nagy előretörést jelentett az ES-sejtvonalakból kiinduló klónozásos
kísérletek területén az, amikor Nagy András kutatócsoportjának sikerült
sejtvonal eredetű, életképes egereket létrehoznia. Még 1989-ben, az ELTE
Gödi Embriológiai Laboratóriumában elindultak ezek a klónozásos kísérletek.
Kétsejtes állapotban levő egérembrió két sejtjét fuzionáltatva
(elektrofúzióval) tetraploid egérembriókat hoztak létre. Ezeket a tetraploid
embriókat használták fel gazdaembrióként. Két-két tetraploid gazdaembriót
aggregáltattak egy-egy 15 ES-sejtet tartalmazó ES-csomóval. A két tetraploid
gazdaembrió és az ES-sejtcsomó egyetlen közös aggregátummá állt össze, majd
a normális embrionális fejlődés menetének megfelelően a morula állapotú
''4. ábra
Embrionális erede-
tű ős-sejtvonalak
alapítása;
ICM - embriócsomó
(inner cell mass);
FB - fibroplaszt
sejtek;
TB - trofoblaszt
sejtekď0
blasztociszta embriócsomójából származtathatók (4. ábra).
Ha a blasztocisztát embrionális eredetű fibroblaszt rétegre helyezzük, a
blasztociszta letapad a fibroblaszt rétegre, a külső trofoblaszt réteg
sejtjei pedig óriás, sokmagvú sejtekké alakulva ránőnek arra, míg az ICM-
sejtjei szorosan együtt maradnak, s az ún. ICM-csomót hozzák létre. Ha a
blasztocisztát hagynánk tovább fejlődni, az ICM-csomó sejtjei
differenciálódni kezdenének. Ha azonban az ICM-csomót izoláljuk a
tenyészetből, s ezt tripszin-cseppben kisebb aggregátumokká
disszociáltatjuk, és ezeket az aggregátumokat friss fibroblaszt rétegre
helyezzük, ezek a kis csomók letapadnak, s különbözó morfológiájú kolóniákat
hoznak létre. Olyan kolóniák is létrejönnek, amelyek továbbra sem
differenciálódó, az ICM sejtjeihez hasonló sejtekből állnak. Ezeket a
kolóniákat ismét izolálni lehet a tenyészetből. A kolóniákat aztán tripszin-
cseppben sejtjeire disszociáltatjuk, s ezt a sejtszuszpenziót helyezzük
friss fibroblaszt sejtrétegre, azaz átpasszáljuk. Ha a keletkező újabb
kolóniák mind egyformák lesznek, s a további passzálások során sem változik
meg a morfológiájuk (kerekded, szorosan kapcsolódó, nagy sejtmagvú, apró
sejtekből épülnek fel), akkor mondhatjuk azt, hogy rendelkezésünkre áll egy
pluripotens embrionális eredetű ős-sejtvonal. Az ES-sejtvonalak optimális
tenyésztési körülmények mellett állandóan osztódó, nem differenciálódó
sejtekből épülnek fel. Az ES-sejteket le lehet fagyasztani, s így a
folyékony nitrogénben gyakorlatilag korlátlan ideig megőrizhetők. Ha a
tenyésztési feltételek megváltoznak, az ES-sejtek a legkülönbözőbb típusú
sejtekké képesek differenciálódni. Ha az ES-sejteket hólyagcsíra állapotban
levő gazdaembrióba injektáljuk vagy két nyolcsejtes gazdaembrióval
aggregáltatjuk, kiméra utódokat kaphatunk. A kimérák minden szövetében,
szervében megtalálhatók lesznek az ES-sejtvonalból származó sejtek, így az
ivarsejtek között is.
Az 1990-es évek során hörcsög-, sertés-, szarvasmarha-, amerikainyérc-,
nyúl-, majom-, patkányembrióból kiindulva is alapítottak ES-jellegű
sejtvonalakat. Ezek a sejtvonalak folyamatosan passzálhatók, tenyészetben
fenntarthatók, megtartják differenciálatlan fenotípusukat és az ES-
sejtvonalak sejtjeire jellemző morfológiát mutatnak.
Klónozás tetraploid gazdaembrió felhasználásával
Ma két olyan módszer ismert, amely segítségével sejtvonal eredetű
utódokat lehet kapni ES-sejtekből kiindulva. Az első esetben egér-ES-
sejtvonal sejtjeit tetraploid gazdaembrióval aggregáltatva, a másikban pedig
birkaembrióból származó ES-sejtet enukleált petesejtbe injektálva kaptak
teljesen sejtvonal eredetű állatokat.
Nagy előretörést jelentett az ES-sejtvonalakból kiinduló klónozásos
kísérletek területén az, amikor Nagy András kutatócsoportjának sikerült
sejtvonal eredetű, életképes egereket létrehoznia. Még 1989-ben, az ELTE
Gödi Embriológiai Laboratóriumában elindultak ezek a klónozásos kísérletek.
Kétsejtes állapotban levő egérembrió két sejtjét fuzionáltatva
(elektrofúzióval) tetraploid egérembriókat hoztak létre. Ezeket a tetraploid
embriókat használták fel gazdaembrióként. Két-két tetraploid gazdaembriót
aggregáltattak egy-egy 15 ES-sejtet tartalmazó ES-csomóval. A két tetraploid
gazdaembrió és az ES-sejtcsomó egyetlen közös aggregátummá állt össze, majd
a normális embrionális fejlődés menetének megfelelően a morula állapotú
 ''5. ábra
Klónozás tetrapolid
gazdaembrióvalď0
embrióból hólyagcsíra állapotú embrióvá differenciálódott. Az így kapott ES-
kiméra embriókat álvemhes nőstény méhébe ültették. A világra jött állat
sejtvonal eredetű volt, de születése után néhány órával elpusztult (5.
ábra).
Ezt követően számos új egér-ES-sejtvonalat alapítottak és próbáltak ki
klónozásos kísérletekben, míg végül az R1 elnevezésű sejtvonalat
felhasználva sikerült (ES-sejtvonal eredetű) életképes állatokat
előállítaniuk. Ma szinte az egész világon ismert ez az R1-sejtvonal, s
nagyon sok laboratóriumban ebből a sejtvonalból kiindulva állítanak elő
transzgénikus ES-sejtvonalakat.
Klónozás birkaemlősejtek felhasználásával
Campbell, Wilmut és munkatársai 1996-ban tudósítottak arról, hogy birka
ES-sejtvonal sejtjeit enukleált birkapetesejtbe injektálva életképes
sejtvonal eredetű utódokat kaptak, amelyhez a sejtmag-átültetéses
kísérletekhez alkalmazott módszert használták fel. A recipiens petesejtből
eltávolították a metafázis-II állapotban levő kromoszómákat, a poláros
testet és a poláros test közvetlen közelében levő citoplazma egy kis
mennyiségét is. Ezt követően birka-ES-sejtet injektáltak az enukleált
petesejtbe, majd elektromos impulzussal segítették elő a recipiens petesejt
és a donor ES-sejt fúzióját. Ez az elektromos impulzus egyben aktiválta is a
petesejtet; s ezzel kezdetét vette a normális embrionális fejlődés. Az így
kapott egysejtes embriókat, ill. az in vitro blasztocisztává fejlődött
embriókat anyaállatba ültették. Sejtvonal eredetű életképes utódokat kaptak.
1997 februárjában ugyanez a kutatócsoport egy újabb publikációt jelentetett
meg, amely az egész világot bejárta. A szenzációt ez esetben az jelentette,
hogy egy felnőtt állat testi sejtjéből, pontosabban egy hatéves birka
emlőszövetéből kivett sejtből hozták létre a nőstény állat genetikai
másolatát (6. ábra).
Wilmut és munkatársai háromféle kísérletet végeztek, az elsőben ES-
sejteket, a másodikban a birkaembrió fibroblaszt sejtjeit; a harmadikban
pedig felnőtt állatból izoláltak emlőssejteket. Aztán mindegyik sejtből egy-
egy sejttenyészetet hoztak létre. A sejteket felszaporították, majd a
''5. ábra
Klónozás tetrapolid
gazdaembrióvalď0
embrióból hólyagcsíra állapotú embrióvá differenciálódott. Az így kapott ES-
kiméra embriókat álvemhes nőstény méhébe ültették. A világra jött állat
sejtvonal eredetű volt, de születése után néhány órával elpusztult (5.
ábra).
Ezt követően számos új egér-ES-sejtvonalat alapítottak és próbáltak ki
klónozásos kísérletekben, míg végül az R1 elnevezésű sejtvonalat
felhasználva sikerült (ES-sejtvonal eredetű) életképes állatokat
előállítaniuk. Ma szinte az egész világon ismert ez az R1-sejtvonal, s
nagyon sok laboratóriumban ebből a sejtvonalból kiindulva állítanak elő
transzgénikus ES-sejtvonalakat.
Klónozás birkaemlősejtek felhasználásával
Campbell, Wilmut és munkatársai 1996-ban tudósítottak arról, hogy birka
ES-sejtvonal sejtjeit enukleált birkapetesejtbe injektálva életképes
sejtvonal eredetű utódokat kaptak, amelyhez a sejtmag-átültetéses
kísérletekhez alkalmazott módszert használták fel. A recipiens petesejtből
eltávolították a metafázis-II állapotban levő kromoszómákat, a poláros
testet és a poláros test közvetlen közelében levő citoplazma egy kis
mennyiségét is. Ezt követően birka-ES-sejtet injektáltak az enukleált
petesejtbe, majd elektromos impulzussal segítették elő a recipiens petesejt
és a donor ES-sejt fúzióját. Ez az elektromos impulzus egyben aktiválta is a
petesejtet; s ezzel kezdetét vette a normális embrionális fejlődés. Az így
kapott egysejtes embriókat, ill. az in vitro blasztocisztává fejlődött
embriókat anyaállatba ültették. Sejtvonal eredetű életképes utódokat kaptak.
1997 februárjában ugyanez a kutatócsoport egy újabb publikációt jelentetett
meg, amely az egész világot bejárta. A szenzációt ez esetben az jelentette,
hogy egy felnőtt állat testi sejtjéből, pontosabban egy hatéves birka
emlőszövetéből kivett sejtből hozták létre a nőstény állat genetikai
másolatát (6. ábra).
Wilmut és munkatársai háromféle kísérletet végeztek, az elsőben ES-
sejteket, a másodikban a birkaembrió fibroblaszt sejtjeit; a harmadikban
pedig felnőtt állatból izoláltak emlőssejteket. Aztán mindegyik sejtből egy-
egy sejttenyészetet hoztak létre. A sejteket felszaporították, majd a
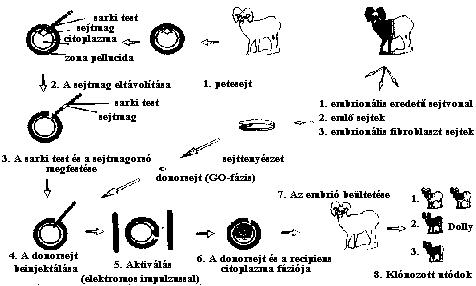 ''6. ábra
Klónozás birka-
emlősejtek fel-
használásával
sejttenyésztő médiumban levő FCS (fetal calf serum) szintjét O,5%-ra
csökkentették. Az alacsony szérumszint hatására a sejtek GO, azaz nyugalmi
fázisba kerültek. A sejttenyészetekből azután egy-egy ilyen nyugalmi
fázisban levő sejtet izoláltak. Ezeket a donor sejteket olyan petesejtbe
injektálták, amelyekből előzőleg eltávolították a sejtmagot és a sarki
testet. A donor sejt és a befogadó recipiens petesejt citoplazmája
elektromos impulzus hatására fúzionált, majd az embrió osztódni kezdett. Ezt
követően az embriót hormonálisan előkészített nőstény állat méhébe ültették.
Mindhárom sejttípus esetében sikerült életképes utódot kapniuk.
Az ES-sejtek, illetve az embrionális eredetű fibroblaszt sejtek
felhasználásához az utódállatok egy ismeretlen tulajdonságú és fenotípusú
embrió genotípusát hordozták. Az emlősejt-tenyészetből kiindulva kapott
utód, Dolly azonban egy ismert tulajdonságú anyaállat genetikai másolata
volt, az első olyan állat a világon, amely felnőtt állat testi sejtjéből
jött létre. Dolly azonban nem tekinthető az emlősejtet adó anyajuh
hasonmásának!
Az egypetéjű ikrekkel folytatott kísérletekbői is kiderült, hogy nincs
két tökéletesen egyforma iker, így az sem várható, hogy klónozással
tökéletesen egyforma utódokat lehessen létrehozni. A genetikailag azonos
ikerállatokat az embrionális fejlődés során, s a megszületést követően is
eltérő környezeti hatások érhetik. A sejtmagátültetések során pedig nemcsak
a donor sejt nukleuszában levő genetikai információ kerül bele az utódba,
hanem a recipiens petesejt citoplazmájában maradó mitokondriumokban levő
mitokondriális DNS is. Az emlősejtek genetikai anyaga a sejtek élete során
sérülhetett, különböző mutációk jöhettek létre, így az emlősejt maga sem
tekinthető már az anyai genom tökéletes másolatának.
Ezért vetődhet fel a kérdés: hány éves is Dolly, ha a recipiens petesejt
citoplazmája egy idősebb sejttel fuzionált? Vajon melyik alkotórész hatása
érvényesül és hány évig fog élni Dolly? Ezekre a kérdésekre Dolly
megfigyelése adhatja csak meg a választ, ami felbecsülhetetlen információkat
nyújthat még az öregedési folyamat kutatóinak.
Ez a leírt módszer még korántsem tekinthető tökéletesnek. Összesen 277
petesejtet használtak fel, míg egyetlen életképes utódot sikerült
létrehozniuk. Az emlősejt-tenyészetben háromféle sejttípust figyeltek meg a
tudósok: emlőhámsejteket, kötőszöveti sejteket, és előfordultak totipotens
őssejtek is. Wilmut és munkatársai nem tudták pontosan megállapítani, hogy
melyik sejttípusból is származik Dolly. Elképzelhető, hogy kivételes
szerencse folytán egy őssejt jellegű sejtet találtak, s más szövetek, sejtek
esetében az általuk ismertetett módszer nem használható.
A birka- és szarvasmarha-embriók korai embrionális fejlődése is eltérő
más emlősök embrionális fejlödésétől, így az egér és ember embrionális
fejlődésétől is. Szarvasmarha- és juhembriók esetében 16 sejtes állapot után
történik csak először átírás (transzkripció) az embrió saját DNS-éről, az
ezt megelőző időszakban a citoplazmájában felhalmozott anyagokat használja
fel. Más fajok embrióiban ennél jóval hamarabb, már kétsejtes (egér),
illetve korai nyolcsejtes állapotban (nyúl, majom, ember) megtörténik a
transzkripció. [7]
Az előbbiekben említett gondolatok is alátámasztják azokat a
megállapításokat, amelyek szerint az ember testi sejtjeiből kiinduló
klónozás, a "szép új világ" utópiájának megvalósulása nem várható a
közeljövőben.
Számos országban már napjainkban is tiltják az ember klónozását célzó
kísérleteket, s több világszervezet állásfoglalása szerint sem fogadható el
az ember klónozása. Maga Ian Wilmut is azt mondta: "Embert klónozni
embertelen lenne." Az emberiség nagy erénye éppen annak sokféleségében
rejlik.
A juhok klónozása figyelemre méltó tudományos eredmény, amelynek komoly
haszna lehet az orvostudományban és a mezőgazdaságban is. Az ES-
sejttenyészetekből származó sejtek alkalmazása pedig új lehetőségeket
biztosít szelektált, uniformizált, genetikailag azonos állatok
előállítására. A klónozott állatok létrehozása hatalmas előrelépést
jelenthet mind az alapkutatás, mind a biotechnológiai és agrárkutatások
területén. A transzgénikus ES-sejtvonalak előzetes szelektálásának
lehetősége olyan új módszert biztosít a tudomány számára, amely
felhasználásával egy teljes populáció gyors és célzott genetikai módosítása
válik lehetővé. A magátültetéses kísérletek tökéletesítésével új lehetőség
nyílt az embriológusok és a molekuláris genetikusok számára. Például az,
hogy megismerjék az embrionális fejlődés, a sejtdifferenciálódás, illetve a
sejtek öregedése során zajló változások molekuláris mechanizmusának főbb
lépéseit (mint például genom-imprinting, illetve a kromoszómarövidülés
folyamata), amelyek a szomatikus sejtekben zajlanak le.
Jegyzetek
[1] Gurdon, J. B. (1975) J. Embryol. Exp. Morph. 34, 93-112.
[2] Willadsen, S. M. (1986) Nature 320, 63-65.
[3] Tsunoda, Y. (1993) Reprod. Fert. 98, 537-540.
[4] Campbell (1996) Nature 380, 64-66.
[5] Wilmut, I. (1997) Nature 385, 810-813.
[6] Nagy, A., (1990) Development 110, 815-821.
[7] Crosby, I. M. (1988) J. Reprod. Fert. 82, 755-769.
Kislexikon
animális sejtek: ---- a petesejt szikben szegény citoplazmájú pólusánál
kialakuló sejtek
blasztociszta: ------ hólyagcsira állapotú embrió
blasztomerák: ------- barázdálódási sejtek
blasztula: ---------- hólyagcsíra állapotú embrió
determináció: ------- a fejlődés során az a folyamat, amelyben eldől, hogy
a sejtek milyen irányba differenciálódhatnak
elektromos fúzió: --- elektromos impulzus hatására összeolvad két baráz-
dálódási sejt
ES-sejtvonal: ------- embrionális eredetű őssejtvonal
fenotípus: ---------- az egyed külső és belső tulajdonságainak az összessége
gasztruláció: ------- a barázdálódáskor létrejött sejtek a gasztruláció
során végleges helyükre kerülnek, kialakulnak a
különböző csíralemezek, amelyekből kiindulva
megindulhat a szervképződés folyamata
genom-imprinting: --- bizonyos gének esetében a DNS által kódolt genetikai
információ módosulhat, egy a DNS-szálra másodlagosan
rátevődő nem genetikai információtól (például a DNS
metilálódása által)
genotípus: ---------- a génekben tárolt genetikai információk összessége
in vitro tenyészetek: az eredeti környezetükből kiszakítva tanulmányoznak
biológiai folyamatokat, szövet-, szem-, sejttenyésze-
teket felhasználva
inner cell mass: ---- a hólyagcsíra állapotú embrió embriócsomója
irreverzibilis: ----- visszafordíthatatlan
kiméra: ------------- különböző eredetű sejtpopulációból felépülő egyed
klón: --------------- egyetlen egyedből ivartalan úton származó genetikailag
egységes utódok összessége
mikromanipulátor: --- olyan készülék, amely alkalmas mikronos méretű pipet-
ták, kések mozgatására
mitokondrium: ------- az oxidatív foszforiláció szolgálatában álló energia-
termelő sejtszervecske
morula: ------------- szedercsíra állapotú embrió
neuruláció: --------- a nerula (idegcsíra) kialakulásának folyamata
passzálás: ---------- sejttenyészetek feltripszinezése után kapott sejt-
szuszpenzió friss, tápláló sejtrétegre helyezése
pluripotens sejtek: - az embrionális fejlődés során szükséges majdnem minden
információt tartalmazó sejtek
poláros testek: ----- sarki testek, a petesejt érése során kizáródó sejtek
reprogramozás: ------ a már egyszer elfedett információ ismét felhasználha-
tóvá válása
tetraploid embrió: -- a kétsejtes embrió két diploid sejtjének összeolvadá-
sát követően létrejövő négyszeres kromoszóma számú
sejtekből álló embrió
totipotens sejtek: -- az embrionális fejlődés során szükséges minden infor-
mációt tartalmazó sejtek
transzkripció: ------ DNS-ről történő RNS-átírás folyamata
''6. ábra
Klónozás birka-
emlősejtek fel-
használásával
sejttenyésztő médiumban levő FCS (fetal calf serum) szintjét O,5%-ra
csökkentették. Az alacsony szérumszint hatására a sejtek GO, azaz nyugalmi
fázisba kerültek. A sejttenyészetekből azután egy-egy ilyen nyugalmi
fázisban levő sejtet izoláltak. Ezeket a donor sejteket olyan petesejtbe
injektálták, amelyekből előzőleg eltávolították a sejtmagot és a sarki
testet. A donor sejt és a befogadó recipiens petesejt citoplazmája
elektromos impulzus hatására fúzionált, majd az embrió osztódni kezdett. Ezt
követően az embriót hormonálisan előkészített nőstény állat méhébe ültették.
Mindhárom sejttípus esetében sikerült életképes utódot kapniuk.
Az ES-sejtek, illetve az embrionális eredetű fibroblaszt sejtek
felhasználásához az utódállatok egy ismeretlen tulajdonságú és fenotípusú
embrió genotípusát hordozták. Az emlősejt-tenyészetből kiindulva kapott
utód, Dolly azonban egy ismert tulajdonságú anyaállat genetikai másolata
volt, az első olyan állat a világon, amely felnőtt állat testi sejtjéből
jött létre. Dolly azonban nem tekinthető az emlősejtet adó anyajuh
hasonmásának!
Az egypetéjű ikrekkel folytatott kísérletekbői is kiderült, hogy nincs
két tökéletesen egyforma iker, így az sem várható, hogy klónozással
tökéletesen egyforma utódokat lehessen létrehozni. A genetikailag azonos
ikerállatokat az embrionális fejlődés során, s a megszületést követően is
eltérő környezeti hatások érhetik. A sejtmagátültetések során pedig nemcsak
a donor sejt nukleuszában levő genetikai információ kerül bele az utódba,
hanem a recipiens petesejt citoplazmájában maradó mitokondriumokban levő
mitokondriális DNS is. Az emlősejtek genetikai anyaga a sejtek élete során
sérülhetett, különböző mutációk jöhettek létre, így az emlősejt maga sem
tekinthető már az anyai genom tökéletes másolatának.
Ezért vetődhet fel a kérdés: hány éves is Dolly, ha a recipiens petesejt
citoplazmája egy idősebb sejttel fuzionált? Vajon melyik alkotórész hatása
érvényesül és hány évig fog élni Dolly? Ezekre a kérdésekre Dolly
megfigyelése adhatja csak meg a választ, ami felbecsülhetetlen információkat
nyújthat még az öregedési folyamat kutatóinak.
Ez a leírt módszer még korántsem tekinthető tökéletesnek. Összesen 277
petesejtet használtak fel, míg egyetlen életképes utódot sikerült
létrehozniuk. Az emlősejt-tenyészetben háromféle sejttípust figyeltek meg a
tudósok: emlőhámsejteket, kötőszöveti sejteket, és előfordultak totipotens
őssejtek is. Wilmut és munkatársai nem tudták pontosan megállapítani, hogy
melyik sejttípusból is származik Dolly. Elképzelhető, hogy kivételes
szerencse folytán egy őssejt jellegű sejtet találtak, s más szövetek, sejtek
esetében az általuk ismertetett módszer nem használható.
A birka- és szarvasmarha-embriók korai embrionális fejlődése is eltérő
más emlősök embrionális fejlödésétől, így az egér és ember embrionális
fejlődésétől is. Szarvasmarha- és juhembriók esetében 16 sejtes állapot után
történik csak először átírás (transzkripció) az embrió saját DNS-éről, az
ezt megelőző időszakban a citoplazmájában felhalmozott anyagokat használja
fel. Más fajok embrióiban ennél jóval hamarabb, már kétsejtes (egér),
illetve korai nyolcsejtes állapotban (nyúl, majom, ember) megtörténik a
transzkripció. [7]
Az előbbiekben említett gondolatok is alátámasztják azokat a
megállapításokat, amelyek szerint az ember testi sejtjeiből kiinduló
klónozás, a "szép új világ" utópiájának megvalósulása nem várható a
közeljövőben.
Számos országban már napjainkban is tiltják az ember klónozását célzó
kísérleteket, s több világszervezet állásfoglalása szerint sem fogadható el
az ember klónozása. Maga Ian Wilmut is azt mondta: "Embert klónozni
embertelen lenne." Az emberiség nagy erénye éppen annak sokféleségében
rejlik.
A juhok klónozása figyelemre méltó tudományos eredmény, amelynek komoly
haszna lehet az orvostudományban és a mezőgazdaságban is. Az ES-
sejttenyészetekből származó sejtek alkalmazása pedig új lehetőségeket
biztosít szelektált, uniformizált, genetikailag azonos állatok
előállítására. A klónozott állatok létrehozása hatalmas előrelépést
jelenthet mind az alapkutatás, mind a biotechnológiai és agrárkutatások
területén. A transzgénikus ES-sejtvonalak előzetes szelektálásának
lehetősége olyan új módszert biztosít a tudomány számára, amely
felhasználásával egy teljes populáció gyors és célzott genetikai módosítása
válik lehetővé. A magátültetéses kísérletek tökéletesítésével új lehetőség
nyílt az embriológusok és a molekuláris genetikusok számára. Például az,
hogy megismerjék az embrionális fejlődés, a sejtdifferenciálódás, illetve a
sejtek öregedése során zajló változások molekuláris mechanizmusának főbb
lépéseit (mint például genom-imprinting, illetve a kromoszómarövidülés
folyamata), amelyek a szomatikus sejtekben zajlanak le.
Jegyzetek
[1] Gurdon, J. B. (1975) J. Embryol. Exp. Morph. 34, 93-112.
[2] Willadsen, S. M. (1986) Nature 320, 63-65.
[3] Tsunoda, Y. (1993) Reprod. Fert. 98, 537-540.
[4] Campbell (1996) Nature 380, 64-66.
[5] Wilmut, I. (1997) Nature 385, 810-813.
[6] Nagy, A., (1990) Development 110, 815-821.
[7] Crosby, I. M. (1988) J. Reprod. Fert. 82, 755-769.
Kislexikon
animális sejtek: ---- a petesejt szikben szegény citoplazmájú pólusánál
kialakuló sejtek
blasztociszta: ------ hólyagcsira állapotú embrió
blasztomerák: ------- barázdálódási sejtek
blasztula: ---------- hólyagcsíra állapotú embrió
determináció: ------- a fejlődés során az a folyamat, amelyben eldől, hogy
a sejtek milyen irányba differenciálódhatnak
elektromos fúzió: --- elektromos impulzus hatására összeolvad két baráz-
dálódási sejt
ES-sejtvonal: ------- embrionális eredetű őssejtvonal
fenotípus: ---------- az egyed külső és belső tulajdonságainak az összessége
gasztruláció: ------- a barázdálódáskor létrejött sejtek a gasztruláció
során végleges helyükre kerülnek, kialakulnak a
különböző csíralemezek, amelyekből kiindulva
megindulhat a szervképződés folyamata
genom-imprinting: --- bizonyos gének esetében a DNS által kódolt genetikai
információ módosulhat, egy a DNS-szálra másodlagosan
rátevődő nem genetikai információtól (például a DNS
metilálódása által)
genotípus: ---------- a génekben tárolt genetikai információk összessége
in vitro tenyészetek: az eredeti környezetükből kiszakítva tanulmányoznak
biológiai folyamatokat, szövet-, szem-, sejttenyésze-
teket felhasználva
inner cell mass: ---- a hólyagcsíra állapotú embrió embriócsomója
irreverzibilis: ----- visszafordíthatatlan
kiméra: ------------- különböző eredetű sejtpopulációból felépülő egyed
klón: --------------- egyetlen egyedből ivartalan úton származó genetikailag
egységes utódok összessége
mikromanipulátor: --- olyan készülék, amely alkalmas mikronos méretű pipet-
ták, kések mozgatására
mitokondrium: ------- az oxidatív foszforiláció szolgálatában álló energia-
termelő sejtszervecske
morula: ------------- szedercsíra állapotú embrió
neuruláció: --------- a nerula (idegcsíra) kialakulásának folyamata
passzálás: ---------- sejttenyészetek feltripszinezése után kapott sejt-
szuszpenzió friss, tápláló sejtrétegre helyezése
pluripotens sejtek: - az embrionális fejlődés során szükséges majdnem minden
információt tartalmazó sejtek
poláros testek: ----- sarki testek, a petesejt érése során kizáródó sejtek
reprogramozás: ------ a már egyszer elfedett információ ismét felhasználha-
tóvá válása
tetraploid embrió: -- a kétsejtes embrió két diploid sejtjének összeolvadá-
sát követően létrejövő négyszeres kromoszóma számú
sejtekből álló embrió
totipotens sejtek: -- az embrionális fejlődés során szükséges minden infor-
mációt tartalmazó sejtek
transzkripció: ------ DNS-ről történő RNS-átírás folyamata